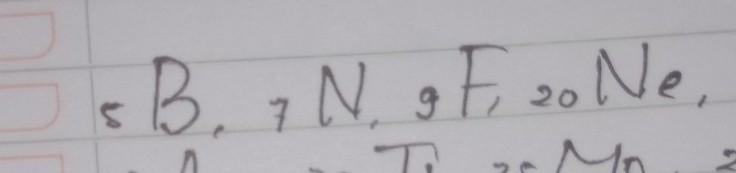Jawaban:
a. n = 2, l = 1, m = -1, s = +1/2
b. n = 2, l = 1, m = +1, s = +1/2
c. n = 2, l = 1, m = 0, s = -1/2
d. n = 2, l = 1, m = +1, s = -1/2
Penjelasan:
Okay let's start from zero :') my bad.
Kembali, hal pertama yang kamu butuhkan adalah 1.) Menuliskan konfigurasi elektronnya, kemudian 2.) Perhatikan subkulit apa yang ditempati oleh elektron terakhir dan berapa jumlah elektron di subkulit tersebut.
a. ₅B = 1s² 2s² 2p¹ → subkulit terakhir: 2p¹, maka:
n (bilangan kuantum utama) : 2, karena kulit terluar berdasarkan konfigurasi elektron tersebut adalah kulit L (yang dapat dinotasikan sebagai n = 2)
l (bilangan kuantum azimuth) : 1, karena l = n-1 dan notasi orbital "p" artinya nilai l = 1
m (bilangan kuantum magnetik) : -1, karena by convention elektron pertama pada subkulit menempati ruang orbital yang paling kiri terlebih dahulu (ingat dan bayangkan orbital p sebagai 3 kotak yang disusun secara horizontal)
s (bilangan kuantum spin) : +1/2, karena by convention elektron pertama pada subkulit akan memiliki spin-up hingga ruang orbital tersebut terisi setengah penuh, barulah diisi dengan elektron yang spin-down.
Oke, kita aplikasikan untuk ketiga soal lainnya yah
b. ₇N : 1s² 2s² 2p³ → n = 2, l = 1, m = +1 (elektron ketiga menempati ruang kotak paling kanan pada orbital p), s = +1/2
c. ₉F : 1s² 2s² 2p⁵ → n = 2, l = 1, m = 0 (elektron kelima menempati ruang kotak tengah pada orbital p), s = -1/2 (karena sudah terisi setengah penuh sebelumnya)
d. ₁₀Ne : 1s² 2s² 2p⁶ → n = 2, l = 1, m = +1 (elektron kelima menempati ruang kotak tengah pada orbital p), s = -1/2 (karena sudah terisi setengah penuh sebelumnya)
P.S. nomor atom Ne bukan 20 yah, tapi 10